GSK-3 (glycogen synthase kinase 3) は、セリンとスレオニンのアミノ酸残基へのリン酸分子の付加を媒介するセリン・スレオニンプロテインキナーゼである。グリコーゲンシンターゼキナーゼ-3、グリコーゲン合成酵素キナーゼ-3などとも呼ばれる。なお直訳すると「グリコーゲンシンターゼ(グリコーゲン合成酵素)をリン酸化する酵素(キナーゼ)」という意味である。GSK-3は、1980年にグリコーゲンシンターゼを調節するキナーゼとして発見され、それが名前の由来となっている。それ以降、GSK-3は様々な経路の40種類以上のタンパク質に対してキナーゼとして機能することが示されている。哺乳類では、GSK-3は2つの遺伝子GSK3A (GSK-3α)、GSK3B (GSK-3β) にコードされていることが知られている。近年、GSK-3は2型糖尿病、アルツハイマー病、炎症、がん、双極性障害など多数の疾患との関連が示唆され、多くの研究の対象となっている。
機構
GSK-3は、標的基質のセリン残基またはスレオニン残基をリン酸化することで機能する。GSK-3は通常、基質を最初にリン酸化する「プライミングキナーゼ」を必要とする。GSK-3の標的リン酸化部位から4アミノ酸C末端側のセリン/スレオニン残基に付加された「プライミング」リン酸基が、活性部位に近接する正に帯電したポケットへ結合する。181、200、97、85番残基によって形成される活性部位は、ATPの末端のリン酸基に結合し、基質の標的部位へリン酸基を転移する。
機能
GSK-3によるタンパク質のリン酸化は通常、下流の標的因子の活性を阻害する。GSK-3は、細胞増殖、細胞遊走、グルコースの調節、アポトーシスなど、細胞内での中心的なシグナル伝達経路の多くに関与している。
GSK-3は元々、グリコーゲンシンターゼの調節に関与する因子として発見された。グリコーゲンシンターゼはカゼインキナーゼ2 (CK2) によって最初のリン酸化 (プライミング) が行われた後、GSK-3によってC末端の3つのセリン残基のクラスターがリン酸化されて活性が低下する。グリコーゲンシンターゼの調節に加え、インスリン受容体基質 (IRS1)、糖新生に関わる酵素ホスホエノールピルビン酸カルボキシキナーゼとグルコース-6-ホスファターゼのリン酸化など、グルコース濃度の恒常性を維持する他の仕組みへの関与も示唆されている 。しかし、これらの経路はGSK-3のアップレギュレーションがなくても阻害され、GSK-3の関与については議論が存在する。
また、GSK-3は免疫や遊走の過程を調節することが示されている。GSK-3は、炎症性サイトカインやインターロイキンの産生といった、自然免疫の応答経路の多くに関与する。様々なキナーゼによるGSK-3βの不活性化は、サイトカインの産生や、CD4陽性T細胞のうちナイーブT細胞と記憶T細胞の増殖といった、獲得免疫の応答機構にも影響を与える。細胞遊走過程は炎症応答に不可欠の要素であるが、それにおけるGSK-3の役割については矛盾する結果が得られている。成長円錐での局所的な阻害は運動性を促進することが示されている一方、細胞全体でのGSK-3の阻害は細胞の伸展や遊走を阻害することが示されている。
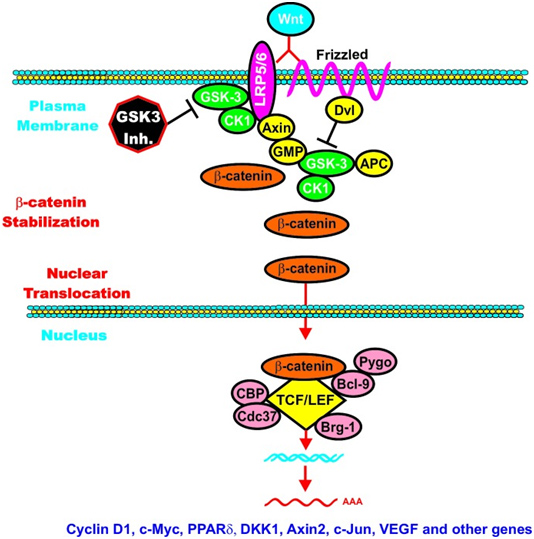
GSK-3は細胞増殖やアポトーシス経路とも密接に関係している。GSK-3はβ-カテニンをリン酸化して分解標的とすることが示されており、細胞分割と細胞増殖のシグナルを伝達するβ-カテニン/Wnt経路の一部を構成する。また、GSK-3はアポトーシスを調節する転写因子をリン酸化し、多くのアポトーシスシグナル伝達経路に関与する。アポトーシスの調節におけるGSK-3の役割に関しては矛盾する結果が得られている。GSK-3はリン酸化によって、p53のようなアポトーシス促進因子を活性化し、生存促進因子を不活性化することでアポトーシスを促進することが報告されている。いくつかの研究では、GSK-3βのノックアウトマウスはアポトーシスに対して過度の感受性となって胚段階で死亡することが示されている一方で、他の研究ではGSK-3の過剰発現がアポトーシスを誘導することが示されている。全体としては、GSK-3はアポトーシスを促進することも阻害することもあり、この調節は特定の分子的・細胞的状況に依存して変化するようである。
調節
GSK-3は多数の細胞機能に関与する重要な因子であり、その活性は緊密な調節を受けている。
GSK-3のリン酸化の速度と効率は多数の因子によって調節されている。GSK-3の特定の残基のリン酸化によって、基質へ結合する能力が向上したり低下したりする。GSK-3βの216番目のチロシン残基 (Tyr216) またはGSK-3αのTyr279のリン酸化はGSK-3の酵素活性を向上させ、GSK-3βのSer9またはGSK-3αのSer21のリン酸化は活性部位の利用可能性を大きく低下させる。さらに、GSK-3は通常、基質を最初にリン酸化する「プライミングキナーゼ」を必要とするという点で特殊である。リン酸化の標的部位から4アミノ酸C末端側にリン酸化セリンまたはスレオニン残基が位置することで、アルギニンとリジン残基によって形成される正に帯電したポケットへ基質が結合できるようになる。
経路に応じて、GSK-3はさらに細胞内局在化やタンパク質複合体の形成といった調節を受ける。皮質ニューロンでは、GSK-3は細胞質よりも核やミトコンドリアにおいて遥かに高い活性を持つ。また、GSK-3によるβ-カテニンのリン酸化は足場タンパク質であるアキシン (Axin) によって媒介され、双方がアキシンに結合することでβ-カテニンはGSK-3の活性部位にアクセスできるようになる。
疾患との関連
大多数のシグナル伝達に関与しているため、GSK-3は注目を集める多くの疾患と関連している。現在、アルツハイマー病、2型糖尿病、一部のがん、双極性障害に対してGSK-3阻害剤の治療効果が試験されている。
現在では、双極性障害の治療に用いられているリチウムは、GSK-3を選択的に阻害することで気分安定薬として機能していることが示されている。GSK-3の阻害が気分を安定させる機構は不明であるが、GSK-3の炎症促進能力を阻害することが治療効果をもたらしている可能性が考えられている。また、GSK-3の阻害は、概日時計に大きな役割を果たす転写抑制因子Rev-ErbAαを不安定化する。概日時計の要素は、双極性障害の傾向と関連している可能性がある。
GSK-3の活性は、アルツハイマー病の病理学的特徴の双方、すなわちアミロイドβの蓄積と神経原線維変化 (neurofibrillary tangle) の形成のいずれにも関連している。GSK-3は直接的にアミロイドβの産生を促進し、tangleをもたらすタウタンパク質の過剰なリン酸化の過程にも関わっていると考えられている。GSK-3のこのようなアルツハイマー病を促進する役割のため、GSK-3阻害剤はアルツハイマー病患者に治療効果がある可能性があり、現在初期段階の試験が行われている。
同様に、GSK-3の標的阻害は特定のがんに対しても治療効果がある可能性がある。いくつかの場合でGSK-3はアポトーシスを促進することが示されている一方、一部のがんでは腫瘍形成に重要な因子であることが報告されている。この主張を支持するものとして、GSK-3阻害剤は神経膠腫と膵臓がんの細胞にアポトーシスを誘導することが示されている。
また、GSK-3阻害剤は2型糖尿病の治療においても有望であることが示されている。糖尿病条件下におけるGSK-3の活性は組織によって完全に異なるが、GSK-3の競合阻害剤によって糖尿病マウスの耐糖能が向上することが研究で示されている。GSK-3阻害剤は急性虚血性脳卒中 (acute ischemic stroke) 後の出血性変化 (hemorrhagic transformation) に対しても治療効果がある可能性がある。
GSK-3の阻害は、T細胞で転写因子T-bet (Tbx21) の転写を増加させ、コリプレッサーであるPD-1の転写を阻害する。GSK-3阻害剤は、免疫療法における抗PD-1抗体と同様に、in vivoでCD8陽性 OT-I CTLの機能と、マウスガンマヘルペスウイルス68株とリンパ球性脈絡髄膜炎ウィルスクローン13株によるウイルス感染のクリアランスを増加させた。
阻害剤
GSK-3の阻害剤には次のようなものがある。
その他: ケタミン
出典
関連項目
- ケタミン
- タウタンパク質キナーゼ
外部リンク
- Glycogen Synthase Kinase 3 - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)

![[antiaging firewalls] The Alpha and Beta of GSK3s first in the](http://www.anti-agingfirewalls.com/__oneclick_uploads/2014/09/GSK3.jpg)